ChatGPT能够颠覆医疗AI吗?
2023年以来,围绕ChatGPT的火热探讨重新燃起了市场对于医疗AI的兴趣。
过去,医疗健康领域的人工智能模型大多只能处理单一模态的数据,解决相对狭窄的医学问题,如识别胸部CT中的黑点,而ChatGPT能够接受多重数据类型的训练,使之像一名医生一样提供完整的医学建议。
然而,坊间对于ChatGPT价值认可各不相同。一部分观点相信大型语言模型(LLM)能够颠覆AI的推理逻辑,优化算法对于医学影像、医学文本的推理,另一部分观点则认为这项技术已经出现多年,如今不过是老调重弹,量变有余,质变不足。
为了明晰ChatGPT能否重构全球医疗AI格局,探明行业的未来发展前景。动脉网与业内多位专家进行了对话,尝试一一解答上述问题。
一、过得了审批,进不了临床
IBM Watson的退场曾对整个生命科学领域予以警示:在面对一种可能的新兴技术时,我们不能单单借助非医疗行业的“主观印象”判断该技术的颠覆性及可用性,还需考虑其应用于医疗领域后,如何切入的诊疗流程、如何面临的审评审批、如何实现商业化等实际问题。
审评审批是决定AI能否存在于市场的重要环节,也是ChatGPT切入临床难以会回避的核心关卡。我们不妨假设:如果基于ChatGPT的AI要以医疗器械的方式实现辅助诊断,需要依赖怎样的审批路径?参照怎样的医疗器械标准?
MedTech Dive曾对FDA批准的AI产品进行了全面的统计。截至2022年10月5日,FDA总计授权了521份AI/ML医疗器械申请,其中绝大部分走的510(k)这一路径,小部分拿到PMA授权,仅18款器械通过的是de novo审批程序。毕竟,510(k)简化了医疗AI的审批流程,尤其是对于不少影像设备厂商,他们的AI应用可能只作用于某一特定模块,只要开发人员能够证明他们的设备与已经上市的设备“基本等效”,就不需要再重新进行临床试验。
NMPA对于AI/ML医疗器械的授权相对谨慎,没有类似于510(k)这样的快速通道可供使用。但随着审批制度的不断完善,大量第二类、第三类智能医疗器械在2018年后涌现,尤其是在科亚医疗“深脉分数”获得三类证,将“深度学习”首次写入注册证基础信息后,医疗人工智能产品的审批迎来爆发式增长。
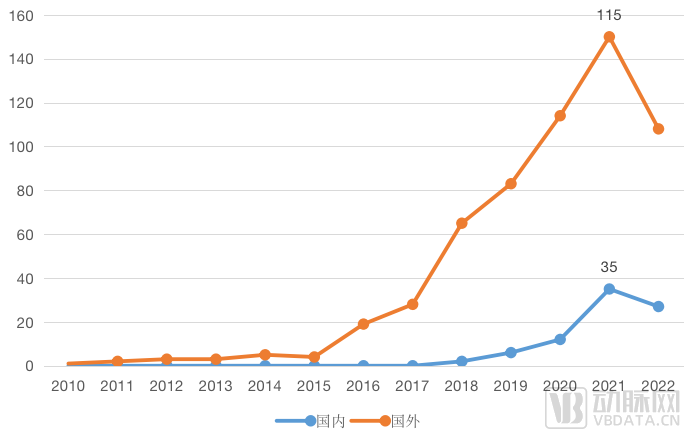
NMPA、FDA历年批准的人工智能医疗器械数量(NMPA仅统计第三类医疗器械)
因此,仅谈论审批路径,NMPA、FDA均对有价值的AI技术张开怀抱。若有企业将基于ChatGPT的AI植入自身的设备之中,并能其与已经上市的设备“基本等效”,那么它很有可能借助510(k)成功上市;2022年3月NMPA发布的《人工智能医疗器械注册审查指导原则》扩展了人工智能核心算法审批的范围,如果LLS能够证明它的价值,亦有可能借助现有框架进入审批流程。
再谈ChatGPT可能的应用场景。NMPA与FDA在审批项目组成上的组成大致相似,截至2022年10月5日,FDA 授权的521份AI/ML医疗器械申请中,超过75%是辅助诊断产品,13%是辅助治疗产品;NMPA授权的70份AI/ML医疗器械申请,超过71%是辅助诊断产品,24%是辅助治疗产品。
辅助诊断产品与辅助治疗类产品严格依赖于临床证据,要求算法能够复现给出的结果,并能给出相应的证据。反观目前ChatGPT模型的应用情况,它能够根据关键词输入给出一个确定的输出结果,但同一关键词的多次输入并不具备一致性。换句话说,当输入信息过于复杂且追求精度时,ChatGPT无法精准复现给出的答案,因而很难用于上述两个领域。
新一代临床辅助决策系统(CDSS)是ChatGPT最有可能颠覆的赛道之一。新一代CDSS依赖于NLP的助力,只能处理文本信息。相较之下,支撑ChatGPT的LLM不仅包含了NLP,还包含众多其他系统,使其具备整合电子病例,图像,检查数据、基因组,甚至微生物组序列信息的能力。
动脉网对2020-2022年期间FDA批准的AI项目整理后发现,尽管辅助诊断与辅助治疗类AI仍占据着主流位置,但CDSS类产品的过审数量较2020年前已显著上升(国内CDSS通常不需要经过NMPA审评审批,仅森亿智能的VTE风险评估软件医疗器械获得了第二类医疗器械认证)。

2020-2022年FDA批准AI医疗器械(部分)
对于整个医疗体系而言,AI带来的监督功能与对于基层医疗的赋能能够有效提高疾病预防的效率,通过推动疾病早治疗,从长期之中减少医保账户支出,从这个角度而言,基于ChatGPT的应用或许存在落地的潜力。
二、谁来为ChatGPT的决策背书?
美国初创公司Ansible Health的研究人员。
版权声明
本文来自互联网用户投稿,文章观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如若转载,请注明出处。如若内容有涉嫌抄袭侵权/违法违规/事实不符,请点击 举报 进行投诉反馈!
