专家点评Nat Neurosci | 闫超/刘翔宇/陈迪俊合作揭示脂堆积的星形胶质细胞在癫痫病理中的作用...
点评 | 许琪(中国医学科学院基础医学研究所)
责编 | 兮
癫痫是常见的神经系统性疾病之一,发病率接近1%,其中约30%的患者会发展为药物难治性癫痫,尤其是伴有海马硬化的颞叶性癫痫患者(temporal lobe epilepsy, TLE),此部分患者除手术外,治疗方法十分有限。TLE患者致痫区的两大主要病理学特征是神经元死亡和胶质瘢痕的产生,胶质瘢痕的主要细胞成分是反应性星形胶质细胞(reactive astrocyte)。反应性星形胶质细胞在老年痴呆症、多发性硬化症等多种神经系统疾病中被发现,且与疾病进展密切相关。然而,在TLE中,反应性星形胶质细胞的功能尚不清楚。
2023年3月20日,南京大学生命科学学院闫超教授、陈迪俊教授联合南京鼓楼医院神经外科刘翔宇主任在Nature Neuroscience在线发表题为 Lipid-accumulated reactive astrocytes promote disease progression in epilepsy 的研究论文。首次揭示TLE患者大脑中存在一种全新的反应性星形胶质细胞,其特征是异常的脂质堆积;这些脂质堆积的反应性星形胶质细胞(lipid-accumulated reactive astrocyte, 简称LARA)以依赖APOE的方式形成,表现出独特的分子表型和功能表型;机制研究表明LARA通过上调腺苷A2A受体表达,降低谷氨酸的重摄取,从而加剧神经元的兴奋性,促进癫痫的疾病进展(图1)。

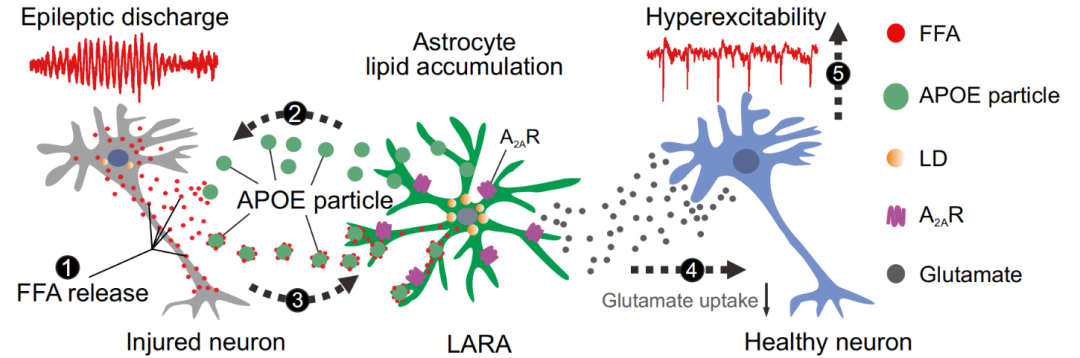
图1. LARA的形成及其促进癫痫进展的原理。
研究人员首先分析了TLE患者的磁共振成像波谱数据,发现患者的致痫侧海马中脂质信号显著升高,提示脂质在致痫侧异常堆积。进一步的免疫荧光和脂代谢组学实验结果表明,致痫灶中的脂质堆积是TLE患者的重要病理特征,并且脂质堆积主要发生在神经元和星形胶质细胞中。
为了探究异常的脂堆积是否会导致脂代谢相关基因的变化,研究人员对TLE患者和正常对照脑组织样本进行了单核RNA测序(snRNA-seq)分析,发现TLE患者的神经元和星形胶质细胞都存在脂代谢和脂转运信号通路的异常激活,其中星形胶质细胞尤为显著,并且APOE在星形胶质细胞中显著高表达。
为了探究APOE是否介导了星形胶质细胞的脂质堆积,研究人员分别使用全身敲除APOE和星形胶质细胞特异性敲除APOE的转基因小鼠建立癫痫模型,发现APOE KO和cKO都能显著阻断星形胶质细胞的脂堆积。基于此,他们提出如下科学假说:在癫痫发作后,神经元过度兴奋产生并分泌大量脂质,星形胶质细胞来源的APOE将脂质转运进星形胶质细胞,造成星形胶质细胞的脂堆积。进一步的离体神经元-星形胶质细胞共培养实验对这一假说进行了验证。
这群高表达APOE并且脂质异常堆积的星形胶质细胞是否是一种新的反应性星形胶质细胞?在TLE中的作用是什么?研究人员对单核RNA测序数据进行进一步分析,将星形胶质细胞细分为6个亚群,其中A4亚群中与脂质代谢和转运相关的基因显著高表达,该亚群也表现出最高的APOE表达水平,其转录组特征不同于之前已报道过的任何一种反应性星形胶质细胞亚型,因此,研究者将这个亚群定义为“脂堆积的反应性星形胶质细胞”,英文简称为LARA。
为了进一步探究LARA的功能表型,研究者在APOE KO小鼠中进行癫痫造模,发现APOE敲除逆转了绝大部分LARA相关基因的表达,证明APOE是LARA形成的必要条件。APOE全身或星胶特异性敲除都能够改善模型小鼠的癫痫症状,说明LARA具有促癫痫的作用。最后,他们还初步探索了LARA促癫痫的潜在分子机制,发现LARA可能通过上调腺苷受体A2AR来发挥促癫痫作用,使用A2AR的抑制剂或使用病毒特异性敲低星形胶质细胞上的A2AR,都能够改善模型小鼠的癫痫症状。
综上,本研究发现在TLE患者致痫区存在异常脂堆积现象,定义了一种全新的反应性星形胶质细胞亚型——LARA,并对LARA在TLE中的分子表型和功能表型进行了系统表征;本研究还首次揭示了APOE在癫痫疾病进展中的作用。靶向LARA或调控脂代谢可能成为耐药性癫痫新的治疗策略。
南京大学生命科学学院闫超教授、医学院附属鼓楼医院神经外科刘翔宇主任、生命科学学院陈迪俊教授为该论文的通讯作者;生命科学学院研究员陈张朋为第一作者兼通讯作者;生命科学学院博士生王素吉、赵贤森、方雯为共同第一作者。该论文还得到了南京大学朱景宁教授、姜晓宏教授、李靓教授和张骑鹏教授,以及西湖大学彭诗宇副研究员的指导与建议。
指的一提的是,Nature Research Briefing同期配发了匿名审稿人的点评:The role of astrocytes in epilepsy is highly understudied, and this manuscript provides compelling evidence that epilepsy-associated astrocytes take on a unique, lipid-accumulating reactive state. Further, the upregulation of adenosine 2A receptors (A2ARs) in reactive astrocytes as a contributor to neuronal hyperexcitability is an intriguing mechanism backed up by precise genetics, including cell-specific knockdown of APOE and A2AR. The novelty of this reactive state and the strength of the genetic evidence make the manuscript incredibly strong.
专家点评

许琪教授(中国医学科学院基础医学研究所)
癫痫是一种常见的神经系统疾病,临床使用的一线抗癫痫药物主要通过调控神经递质和离子通道活动,降低神经元兴奋性实现治疗目的。然而,约有三分之一的癫痫患者接受靶向神经元的药物治疗后效果不佳,逐渐发展为药物难治性癫痫。因此,探索癫痫发病的新机制,寻找新的药物靶点十分必要。反应性星形胶质细胞在AD和PD等神经疾病中的功能近年来受到广泛关注,然而星形胶质细胞在药物难治性癫痫中的作用及神经机制尚不清楚。
在本研究中,南京大学闫超教授通过与神经外科团队和生物信息学团队的合作,对癫痫患者致痫灶中的星形胶质细胞的分子表型与功能表型进行了系统性研究,鉴定了一个与癫痫疾病进展密切相关的星形胶质细胞亚型LARA,结合临床病人样本与动物模型,全面探究了APOE介导LARA形成的机制,以及LARA促进癫痫进展的分子机制,在此基础上提出靶向LARA可能成为治疗药物难治性癫痫的新选项。
这是一项非常漂亮的神经和代谢领域的交叉研究工作,首次将脂代谢异常和癫痫联系到一起,也是首次提出APOE和癫痫的潜在关联。本研究也是胶质细胞研究领域的重要进展,通过对癫痫患者星形胶质细胞进行疾病特异性分型,定义了LARA的存在,丰富了人们对于星形胶质细胞病理功能的理解,为靶向星形胶质细胞治疗药物难治性癫痫奠定了理论基础。
博士后招聘:
南京大学闫超教授课题组长期招聘博士后和助理研究员。闫超教授是国家级海外高层次引进人才,现任南京大学生理学系主任,课题组致力于神经药理学与肿瘤药理学研究,代表性论文发表于Nature, Nature Neuroscience, Cell Research, JCI, Nature Communications, Cancer Research, Autophagy等杂志,欢迎有识之士加入。
原文链接:
https://www.nature.com/articles/s41593-023-01288-6
制版人:十一
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
机器学习
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集


本文来自互联网用户投稿,文章观点仅代表作者本人,不代表本站立场,不承担相关法律责任。如若转载,请注明出处。 如若内容造成侵权/违法违规/事实不符,请点击【内容举报】进行投诉反馈!



























